 Hémoglobine
Hémoglobine
Dernière mise à jour : 2021.11.19
L'hémoglobine (Hb) est une chromoprotéine : la protéine (globine) est liée à un groupe prostétique (l'hème). Cette combinaison rend l'hème soluble. L'ensemble forme une protéine sphérique caractérisée par 4 incurvations contenant chacune un hème.
L'hémoglobine est donc un tétramère quaternaire, constitué d'une apo-enzyme + un groupe prostétique (voir également : "Enzymes") :
-
-
globine : chaîne de polypeptides synthétisée dans des ribosomes,
-
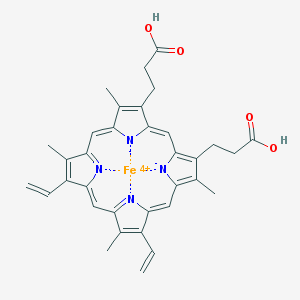
hème : formé de 4 protomères, joints entre eux par des ponts méthine : les 8 atomes de carbone sur la face extérieure peuvent héberger différents groupes (porphyrines). Au milieu du groupe hème se trouve un atome de fer sous sa forme ferreuse (Fe2+).
-
L'hémoglobine occupe une place importante dans le système de tampon sanguin : ceci est dû à sa concentration plus élevée dans les érythrocytes (globules rouges) par rapport à la concentration des protéines sériques (voir aussi : "Equilibre acido-basique, systèmes de tampon").
L'hémoglobine est exprimée en % (normalement 25 à 35%). Plus le % d'hémoglobine est élevé, plus la délivrance d'oxygène au niveau des muscles est importante. L'hématocrite représente le % relatif du volume des globules rouges dans le sang par rapport au volume total du sang (volume%). Une élévation de la valeur de l'hématocrite de 40 à 50%, augmente donc de 25% la concentration des globules rouges et proportionnellement la délivrance maximale d'oxygène au niveau des muscles. Le rôle du fer est ici crucial : trop de fer peut nuire à la santé de l'organisme, trop peu peut nuire aux prestations de l'organisme.
Sommaire :
Contenu :
 Synthèse et dégradation :
Synthèse et dégradation :
Synthèse :
-
-
au cours du développement d'un érythrocyte, la transferrine et la ferritine cèdent un atome de fer,
-
dans les mitochondries, la protoporphyrine est formée à partir de la Glycine et la succinyl CoA,
-
en insérant du fer, le groupe hème est complété,
-
sous l'influence d'une enzyme, la hémoglobine synthétase, l'hémoglobine est formée par concaténation d'hème et de globine.
-
Dégradation :
-
-
en général, l'hémoglobine est dégradée par des phagocytes dans la rate, le foie et la moelle osseuse (bien que cette dégradation puisse se dérouler également à d'autres endroits, p. ex. lors d'une hémorragie...),
-
-
-
l'hémoglobine libérée est immédiatement liée à l'haptoglobine, une protéine spécifique de transport, afin d'éviter que l'hémoglobine (et en particulier le fer et la partie aminée) soit éliminée par voie rénale,
-
-
-
ensuite l'hémoglobine est dégradée en globine et en prophyrines de fer :
-
-
-
-
la globine est alors décomposée en acides aminés, unités réutilisables par l'organisme dans la synthèse de nouvelles protéines.
-
-
-
-
-
de son côté, le cycle de prophyrine, est forcé afin de récupérer le fer enfermé : ce dernier est ensuite fixé sur la transferrine, transporté vers le foie ou vers la moelle osseuse pour équiper de nouveaux globules rouges. Le reste (porphyrine sans fer) est dégradé en Bilirubine, transporté par l'albumine vers le foie, conjugué à l'acide glucuronique et éliminé par voie fécale (voir : "La détoxication").
-
-
 Echanges d'oxygène au niveau du groupe hème :
Echanges d'oxygène au niveau du groupe hème :
-
-
L'atome de fer possède 6 ligands (= groupe présentant une paire d'électrons libres), dont 4 d'entre eux sont liés aux atomes d'azote du hème. Le cinquième ligand de l'atome de fer est lié à un acide aminé, la histidine, et le sixième peut une molécule d'O2, de CO2..., dans une des incurvations de l'hémoglobine.
-
désoxyhémoglobine (tétramère) + 4 O2 ---> oxyhémoglobine
-
-
La liaison avec l'oxygène est un procédé coopératif : dès qu'une molécule d'oxygène est liée à un hème, la liaison d'une autre molécule d'oxygène à un des autres hèmes du même tétramère est facilitée. L'affinité de liaison de l'hémoglobine est donc affectée par la saturation en oxygène du tétramère.
-
-
-
Inversement, l'affinité de l'hémoglobine pour l'oxygène décroît lorsqu'elle libère facilement de l'oxygène... : suivant le principe de l'effet de Bohr, l'oxygène se dissout dans le plasma ou il est fixé à l'hémoglobine. L'affinité de l'hémoglobine pour l'oxygène est déterminée par le 2.3 DPG (diphosphoglycérate, venant de la glycolyse anaérobie), qui influence d'une façon directe le pouvoir transporteur de l'hémoglobine.
-
-
-
Après diffusion sanguine, le dioxyde de carbone (CO2) est lié à l'acide aminé histidine provenant de l'hémoglobine ou transporté sous forme de bicarbonate ou de gaz dissous.
-
 Dérivés d'hémoglobine :
Dérivés d'hémoglobine :
-
-
methémoglobine ou hémiglobine : l'oxydation dans les érythrocytes de fer ferreux Fe2+ en fer ferrique Fe3+ entraîne la formation de la methémoglobine (p. ex. suite à la présence de nitrates dans l'alimentation). Cette hémoglobine est incapable de fixer l'oxygène; au contraire, elle repousse même l'oxygène! L'enzyme, la methémoglobine réductase dans l'érythrocyte réduit, à l'aide du NADH et du NADPH2 (de la glycolyse) la methémoglobine formée. La vitamine C ainsi que le glutathion peuvent réduire la methémoglobine.
-
-
-
carboxyhémoglobine (HbCO) :
-
-
-
-
l'affinité d'hémoglobine pour le monoxyde de carbone (CO) est nettement plus élevée que son affinité pour l'oxygène : la présence d'HbCO dépend donc de l'environnement.
-
-
-
-
-
lorsqu'une molécule de CO est fixée à 1 des 4 groupes hèmes, les autres groupes hèmes sont incapables de fixer de l'oxygène.
-
-
-
-
hémoglobine glycolysée (HbA1c) :
-
-
-
-
l'hémoglobine possède la capacité de se fixer au glucose présent dans le sang, en formant de l'hémoglobine glycosylée ; étant donné que les globules rouges (qui portent l'hémoglobine) vivent en moyenne 2 à 3 mois, le taux d'HbA1c peut être considéré comme indicateur des taux moyens du glucose sanguin durant les 2 à 3 derniers mois. Déterminer les taux d'HbA1c ne peut en aucun cas remplacer les contrôles journaliers de la glycémie. (voir aussi : "Le Diabète").
-
-
 Déséquilibres :
Déséquilibres :
Anémie :
Déficits en Hb :
-
-
en cas de taux sanguins d'hémoglobine inférieurs à 12g/dl (femme) et inférieurs à 13g/dl (homme).
-
symptômes : plaintes confuses telles que fatigue, palpitations, tâches noires devant les yeux en se levant précipitamment, étourdissements, bourdonnements, pâleur, perte de l'appétit, ...
-
effets sur l'organisme : hypoxie tissulaire liée à des problèmes de transport d'oxygène, pouvant entraîner un dysfonctionnement tissulaire.
-
Mécanismes de compensation :
-
-
diminution de la résistance périphérique : offrant une accessibilité facilitée aux tissus,
-
élévation des taux du 2.3 DPG : avec une meilleure libération d'oxygène au niveau des tissus (voir aussi : l'effet de Bohr),
-
répartition de l'irrigation sanguine dans certaines zones de l'organisme,
-
augmentation des taux d'éryproétine.
-
Types :
-
-
une anémie par carence ferrique : causée par une absorption insuffisante de fer alimentaire ou par une perte de sang considérable.
-
une anémie pernicieuse : causée par un déficit de sécrétion par la muqueuse intestinale du facteur intrinsèque, entraînant une malabsorption de la vitamine B12.
-
une anémie macrocytaire : causée par un déficit en vitamine B12 (ou également en acide folique) avec des globules rouges anormalement grandes.
-
