 Hemoglobine
Hemoglobine
Laatste bijwerking : 2021.11.19
Hemoglobine (Hb) is een chromoproteïne : het proteïne (globine) is gebonden aan een prostetische groep (heem). Door deze binding is het heem oplosbaar. Het geheel vormt een bolvormig eiwit met 4 instulpingen waarin zich de heemgroepen bevinden.
Hemoglobine is dus een tetrameer met een kwaternaire structuur, opgebouwd uit een apoenzym + een prostetische groep (zie ook "Enzymen").
-
-
globine : polypeptide-keten aangemaakt in de ribosomen,
-
heem : bestaat uit 4 aan elkaar gekoppelde methinebruggen : de 8 koolstofatomen op de buitenzijde kunnen verschillende groepen (porfyrines) bevatten. In het midden van de heemgroep bevindt zich het ijzeratoom in de ferrovorm (Fe2+).
-
Hemoglobine neemt een belangrijke plaats in als buffersysteem in het bloed : dit komt omdat de concentratie hemoglobine in de erytrocyten (rode bloedcellen, RBC) veel hoger is dan deze van de plasma-eiwitten (zie ook : "Zuur-base evenwicht, buffersystemen").
De hemoglobine-waarde wordt uitgedrukt in % (normaal 25 à 35%). Hoe groter % hemoglobine, hoe meer zuurstof erin de spieren wordt afgegeven. De hematocriet waarde is de verhouding van de aangemaakte RBC op het totale bloed (volume%). Een verhoging van de hematocriet-waarde van 40 naar 50%, verhoogt aldus de concentratie van RBC met 25% en doet de maximale zuurstofafgifte in de spieren evenredig stijgen. De rol van ijzer is hier cruciaal : teveel veroorzaakt schade aan het organisme, te weinig weegt op de prestaties van het organisme.
Overzicht inhoud :
Inhoud :
 Synthese en afbraak :
Synthese en afbraak :
Synthese :
-
-
bij de ontwikkeling van de erytrocyt wordt er door transferrine en ferritine ijzer afgestaan,
-
in de mitochondria wordt uit glycine en succinyl CoA protoporfyrine gevormd,
-
door de inbouw van ijzer wordt de heemgroep gecompleteerd,
-
onder invloed van het enzym hemoglobinesynthetase wordt het heem en het globine gelinkt.
-
Afbraak :
-
-
gebeurt hoofdzakelijk door fagocyten in de milt, de lever en het beenmerg (doch kan ook op andere plaatsen bv. bij bloeduitstorting...),
-
-
-
het vrijgekomen hemoglobine wordt onmiddellijk gebonden aan haptoglobine, een specifiek hemoglobine-transporteiwit om te verhinderen dat het hemoglobine (vooral het ijzer en het aminogedeelte) zou verloren gaan via de nieren. Verdere afbraak geschiedt door het loskoppelen van de globine van de heemgroepen. Het globine wordt verder afgebroken in de lever waar de bekomen onderdelen terug kunnen dienen voor de aanmaak van nieuwe eiwitten,
-
-
-
van de heemgroep wordt de porfyrine-ring opengebroken : het hierbij vrijgekomen ijzer wordt gebonden aan transferrine en vervoerd naar de lever of het beenmerg voor herinbouw in de RBC. De rest van het heem wordt verder afgebroken met de vorming van Bilirubine en op albumine getransporteerd naar de lever waar het wordt geconjugeerd met glucuronzuur voor uitscheiding via de feces (zie : "Ontgifting").
-
 De zuurstofuitwisseling speelt zich af aan de heemgroep :
De zuurstofuitwisseling speelt zich af aan de heemgroep :
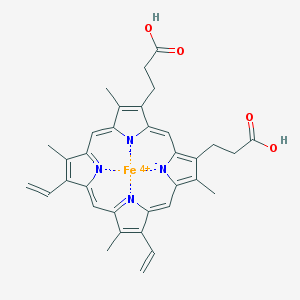
-
-
Het ijzeratoom heeft 6 liganden (groep met vrij elektronenpaar), waarvan 4 liganden verbonden zijn met de stikstofatomen van de heemgroep. Met 1 ligand is het ijzeratoom gebonden aan een aminozuurgroep (histidine) en met het 6de ligand kan een O2, CO2... molecule gebonden worden, via een opening in het hemoglobinemolecule.
-
deoxyhemoglobine (tetrameer) + 4 O2 ---> oxyhemoglobine
-
-
Als er 1 zuurstofmolecule aan een heemgroep gebonden is kan een ander zuurstofmolecule zich gemakkelijker aan een van de andere heemgroepen van hetzelfde hemoglobinetetrameer binden (coöperatief effect). Verdere zuurstofopname gaat telkens gemakkelijker.
-
-
-
Omgekeerd is de zuurstofaffiniteit van hemoglobine gering wanneer hemoglobine de zuurstof gemakkelijk afgeeft... : volgens het principe van het Bohr, wordt zuurstof opgelost in het plasma of aan hemoglobine gebonden. De affiniteit van hemoglobine voor zuurstof wordt bepaald door het 2.3 DPG (difosfoglyceride, uit de anaërobe glycolyse) : dit laatste heeft rechtstreeks invloed op het transportvermogen van hemoglobine.
-
-
-
Na diffusie in het bloed wordt koolstofdioxide (CO2) gebonden aan de aminogroep histidine van het hemoglobine of vervoerd in de vorm van bicarbonaat of in de vorm van opgelost gas.
-
 Hemoglobinederivaten :
Hemoglobinederivaten :
-
-
Methemoglobine of hemiglobine : oxidatie van Fe2+ tot Fe3+ in de erytrocyten doet methemoglobine ontstaan (bv. door nitraten in de voeding). Dit hemoglobine is ongeschikt voor het vervoer van zuurstof, het stoot zuurstof zelfs af. Het enzym methemoglobinereductase in de erytrocyt reduceert met behulp van NADH en NADPH2 (uit de glycolyse) het gevormde methemoglobine. Ook vitamine C en glutathion kunnen het methemoglobine reduceren.
-
-
-
Carboxyhemoglobine (HbCO) :
-
-
-
-
de affiniteit van hemoglobine voor koolstofmonoxide (CO) is veel groter dan voor zuurstof : het voorkomen van HbCO is enkel afhankelijk van de leefomgeving.
-
-
-
-
-
indien een molecule CO aan 1 van de 4 heemgroepen gebonden is, zijn de andere heemgroepen niet meer in staat zuurstof te binden.
-
-
-
-
Versuikerde hemoglobine (HbA1c) :
-
-
-
-
hemoglobine bezit de capaciteit zich te hechten aan de glucose in het bloed, wat leidt tot de vorming van "gesuikerde" hemoglobine ; daar de rode bloedcellen (die het hemoglobine bevatten) gemiddeld 2 à 3 maanden leven, mag het gehalte HbA1c beschouwd worden als een goede indicator van de gemiddelde glykemie-waarden gedurende deze periode. De HbA1c testen kunnen in geen geval de dagelijkse zelfcontrole-testen vervangen (zie ook : "Diabetes").
-
-
 Onevenwichten :
Onevenwichten :
Anemie (bloedarmoede) :
Tekort aan Hb :
-
-
bij hemoglobinegehalte in het bloed lager dan 12g/dl (vrouw) en lager dan 13g/dl (man).
-
symptomen : vage klachten zoals vermoeidheid, hartkloppingen, zwarte stippen voor de ogen bij te bruusk opstaan, duizeligheid, oorsuizingen, bleke huid, verminderde eetlust,....
-
effecten op het organisme : weefselhypoxie door problemen met het zuurstoftransport, welke kan leiden tot een weefseldysfunctie.
-
Compensatiemechanismen :
-
-
daling van de perifere weerstand : gemakkelijkere bereikbaarheid van de weefsels.
-
stijging van het gehalte 2.3 DPG : betere afgifte van zuurstof ter hoogte van de weefsels (zie ook Bohr-effect).
-
herverdeling van de bloeddoorstroming in bepaalde zones van het organisme.
-
stijging van de concentratie eryproëtine.
-
Types :
-
-
anemie door ijzertekort veroorzaakt door een onvoldoende opname van ijzer uit de voeding of door overmatig bloedverlies.
-
pernicieuze anemie : door tekort aan intrinsiek factor en hierdoor malabsorptie van vitamine B12.
-
megaloblastische anemie : door tekort aan vitamine B12 (of ook aan foliumzuur) worden abnormaal grote rode bloedcellen gevormd.
-