Le métabolisme des protéines
Le métabolisme des protéines
Dernière mise à jour : 2021.11.19
La décomposition des macromolécules (protéines) en composants simples tels que les acides aminés et les peptides représente la première étape dans le catabolisme des protéines. Cette décomposition enzymatique débute dans l'estomac (pepsine) et se déroule ensuite dans l'intestin grêle (trypsine, chymotrypsine, elastase, carboxypeptidases). Il s'agit d'un système de conversion de molécules organiques en éléments utiles pour l'organisme. En effet, les petites molécules peuvent traverser la paroi intestinale vers la circulation sanguine et finalement vers la cellule (à l'aide du glucagon). Les acides aminés forment là les pièces de base pour la composition de nouveaux peptides (anabolisme), ou peuvent être convertis vers d'autres acides aminés (recyclage). Finalement l'excès d'acides aminés est dégradé via le cycle d'acide citrique et le cycle de l'urée (catabolisme). Toutefois, lorsque la digestion est défaillante (pH gastrique et/ou intestinal incorrect (p. ex. l'achlorhydrie : voir "Les troubles gastro-intestinaux"), stress, allergies, ...), la dégradation des protéines n'est que partielle, augmentant le risque de passage inapproprié de la barrière intestinale par des groupements protéinés non dégradés.
Stimulée par un repas azoté, la libération de l'hormone glucagon aide à transformer au niveau du foie la plupart des acides aminés en glucose (gluconéogenèse), tandis que la sécrétion d'insuline, responsable de la digestion glucidique, reste faible ; le glucagon permet aux acides aminés de traverser les membranes cellulaires (anabolisme).
Sommaire :
 L'anabolisme des protéines
L'anabolisme des protéines
Contenu :
 L'anabolisme des protéines :
L'anabolisme des protéines :
Biorythme : catabolisme > anabolisme protéique dans la matinée.
Source : alimentation + recyclage par le métabolisme protéique
-
-
la synthèse protéique : via cette synthèse, les acides aminés sont liés ensemble pour former des polymères, les protéines. Cet anabolisme à lieu dans les ribosomes à l'aide d'autres protéines. En effet, cet enchaînement des acides aminés est codé par le génome et constitue la structure primaire (la séquence exacte des acides aminés). L'insuline stimule la synthèse protéique, lorsque l'apport de protéines est suffisamment élevé (entre 15 et 20%)
 .
.
-
![]() Lorsque l'apport de protéines est trop élevé, elles peuvent être converties et stockées comme GRAISSES (lipogenèse via l'acétylCoA)!
Lorsque l'apport de protéines est trop élevé, elles peuvent être converties et stockées comme GRAISSES (lipogenèse via l'acétylCoA)!
-
-
la synthèse d'hémoglobine : les acides aminés méthionine, thréonine, valine, isoleucine, leucine avec le succinyl CoA (cycle de l'acide citrique) pour former des porphyrines et ensuite un hème (dégradation : la Bilirubine via les selles).
-
-
-
la synthèse de la créatine (dégradation : la créatinine via les urines).
-
-
-
la synthèse des purines (thymine, cytosine, uracile...) : obtenues après désamination, elles forment des composants d'acides nucléiques tels que ADN et ARN... (dégradation : acide urique via les urines).
-
-
-
la synthèse des pyrimidines (adénine, guanine...) : obtenues après désamination + CO2 via le carbamyl-P.
-
-
-
la synthèse des amines biogènes après la décarboxylation (voir plus loin).
-
 Le catabolisme protéique : par des protéinases
Le catabolisme protéique : par des protéinases
Biorythme : anabolisme > catabolisme protéique dans l'après-midi.
1. Transamination d'acides aminés : cette réaction réversible comprend l'échange d'une fonction amine primaire entre un acide aminé et un alpha-cétoacide :
p. ex. : l'alpha kétoglutarate avec
-
-
-
l'alanine comme source d'amines ---> acide glutaminique et pyruvate via l'enzyme GPT en présence de la vitamine B6 comme cofacteur.
-
-
-
-
-
l'aspartate comme source d'amines ---> glutamate et oxaloacétate via l'enzyme GOT en présence de la vitamine B6 comme cofacteur.
-
-
Note :
-
-
-
le pyruvate est ensuite utilisé dans la glycolyse et l'oxaloacétate dans le cycle de l'acide citrique.
-
les GPT et GOT sont des enzymes hépatiques : des taux trop élevés indiquent une synthèse protéique défaillante
-
-
Attention : une conversion trop lente ou trop rapide peut causer des détériorations par surdosage ou par épuisement de certains acides amines; des dommages hépatiques peuvent être évités en ajoutant à l'alimentation de la vitamine B6 et d'acides aminés lipotrophes tels que choline, lécithine, méthionine, cystéine, bétaïne, inositol, taurine, ...
2. Décarboxylation d'acides aminés : élimination d'un groupement -COOH (carboxyle) avec formation d'amines biogènes (adrénaline..., hormones peptidiques) en libérant une molécule de CO2 via une enzyme, la décarboxylase :
-
-
il s'agit ici d'une possibilité de créer des acides aminés à partir d'autres acides aminés :
-
p. ex. :
asparagine ---> alanine
histidine ---> histamine
3. Désamination d'acides aminés : élimination d'un groupement amine avec formation de l'ammoniac NH3 toxique.
-
-
l'ammoniac peut ensuite être fixé et éliminé (cycle de l'urée hépatique) sous forme d'urée (via les urines) et sous forme d'acides cétocarboniques qui sont dégradés via le cycle de l'acide citrique (acétylCoA) en CO2 (éliminé via les poumons) et eau.
-
.
-
-
de cette façon, l'acide glutaminique peut être reconverti en alpha-kétoglutarate par désamination oxydative via l'enzyme, la glutamine déshydrogénase, présente dans les mitochondries de toutes les cellules.
-
4. Le cycle de l'acide citrique : le cycle de l'acide citrique est un cycle d'oxydation (l'oxydation est une réaction de cession d'électrons) des molécules provenant de la dégradation des lipides, des glucides et des acides aminés. Le produit final du cycle de l'acide citrique est le dioxyde de carbone (CO2). Toutefois, il ne s'agit pas d'une oxydation de ces molécules au sens propre, mais d'une utilisation d'oxygène (nécessaire pour oxyder les coenzymes réduits, le NADH et le FADH2), accompagnée d'un transfert d'électrons via un mécanisme de porteurs utilisant l'oxygène comme accepteur final d'électrons.
ATTENTION :
-
-
la transamination et la désamination peuvent exister l'une à côté de l'autre.
-
-
-
chaque acide aminé qui subit une désamination peut être transformé ensuite en glucose via la gluconéogenèse : la synthèse glucidique à partir de protéines et de lipides sous influence de l'hormone surrénale, le cortisol.
-
Cette voie fournit du glucose, lorsque une pénurie glucidique se manifeste dans les cellules (cerveau...) et lorsque les taux de lactate s'élèvent.
L'hormone glucagon signale le taux sanguin trop faible du glucose, arrête la glycolyse et lance la gluconéogenèse.
D'autre part, l'insuline freine la protéolyse (et stimule la synthèse protéique : voir plus haut).
 L'équilibre du turn-over protéique
L'équilibre du turn-over protéique
Le catabolisme et l'anabolisme (= forment ensemble le turn-over) doivent être constamment en équilibre pour le maintien d'un métabolisme protéique optimal. Surtout la vitesse de synthèse des protéines est très important : elle doit éviter un déficit de protéines actives, causé en particulier par une formation de liens croisés (cross-linking), qui rendent une protéine inactive.
Une diminution de la capacité de récupération de l'ADN (qui dirige la synthèse protéique) ainsi que l'endommagement de l'ADN par des radicaux libres ou des agents toxiques ralentit la synthèse protéique chez la personne âgée. En outre, des fautes de transcription et de traduction durant la synthèse protéique sont responsables d'erreurs de fabrication (enzymes, ....). L'ensemble de ces dégradations entraîne une perte fonctionnelle cellulaire.
D'autre part, une stimulation excessive du pancréas (due à un apport trop élevé de protéines, de graisses et/ou de carbohydrates, à une acidité gastrique insuffisante mais également entraîné par le café, le tabac, le stress, des médicaments, la pollution,...) peut provoquer une insuffisance pancréatique par un déficit en bicarbonate, perturbant la digestion des protéines ainsi que leur dégradation. A terme, une déficience en acides aminés essentiels en non essentiels s'installe, malgré des apports élevés de protéines par l'alimentation. Cette perturbation déréglera ensuite la synthèse hormonale et des enzymes (dont celle des enzymes protéolytiques) et affectera le système immunitaire.
 Schémas
Schémas
|
|
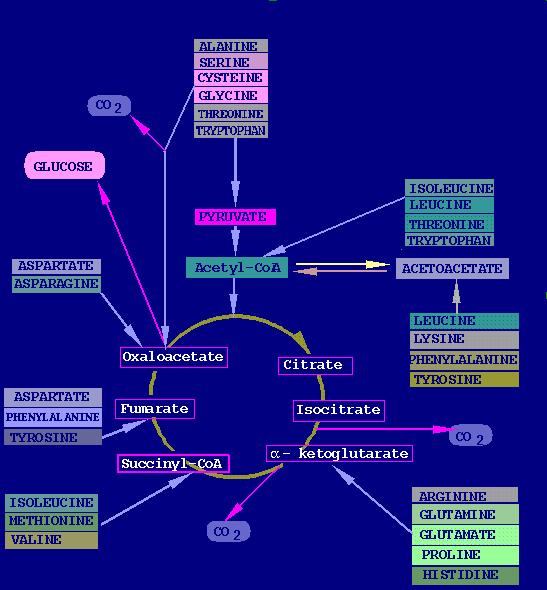
Le catabolisme des acides aminés dans le cycle de Krebs
|
|
|
L'implication des acides aminés dans le cycle de Krebs (glycolyse aérobie) dans les mitochondries. |
|
|
|
|
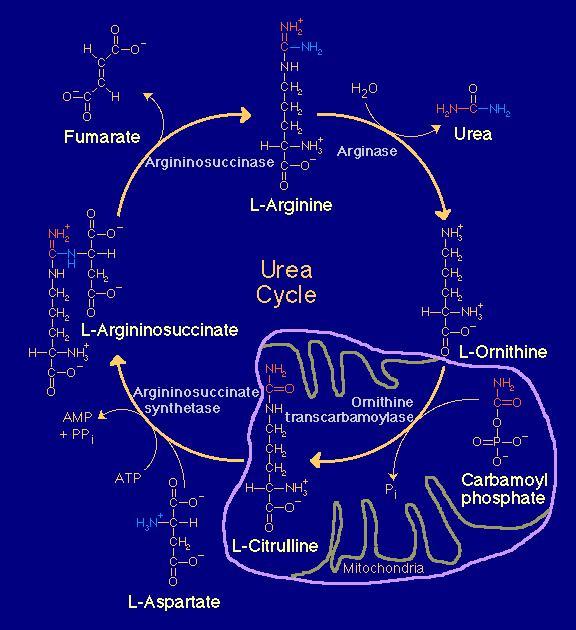
Le cycle de l'urée (avec le cycle de l'ornithine) |
|
|
Le cycle de l'urée se déroule dans le foie. L'urée est le produit final du métabolisme de l'azote et se trouve éliminée par les reins.
L'ammoniac NH3 et le dioxyde de carbone CO2 sont libérés après la désamination d'acides aminés, utilisant l'asparagine et la glutamine comme derniers intermédiaires.
L'ammoniac entre dans le cycle d'urée lors de la synthèse du carbamyl phosphate (1) (à partir de l'ammoniac, de l'ATP et du dixoyde de carbone dans la mitochondrie) et quitte le cycle lors de la conversion de l'arginine en ornithine + urée (2) (--> via les reins).
|
Dans le cycle de l'urée, 3 acides aminés interviennent : L-Arginine, L-Ornithine et L-Citrulline.
Une perturbation du cycle d'urée n'entraîne ni acidose, ni cétose ou hypoglycémie ; toutefois, l'ammoniac exercera un effet toxique direct sur le système nerveux central. Le même effet se manifeste lorsque l'urée ne peut pas être éliminée par voie rénale.
|
(2)
(1)
|
|
|
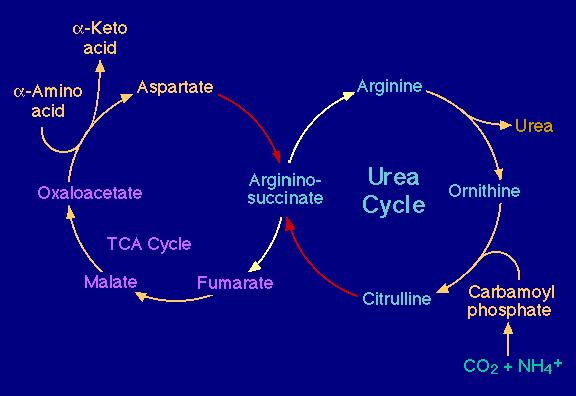
L'interaction entre le cycle de Krebs et le cycle de l'urée
|
|
|
Interaction entre le cycle de l'urée et le cycle de l'acide citrique (Krebs)
Input : l'aspartate après transamination
le carbamyl phosphate (à partir de CO2 + NH4 e.a. provenant du cycle de Krebs)
Output : l'urée (---> via les urines) des acides alpha kétocarboniques (---> Krebs)
|
|
|