 Les coenzymes
Les coenzymes
Dernière mise à jour : 2021.11.19
Les coenzymes représentent un groupe de composés organiques qui ont besoin d'enzymes afin de catalyser les réactions biochimiques. Pour l'activation de l'enzyme, le coenzyme est un facteur indispensable, capable de s'associer à la partie protéique de l'enzyme.
La plupart de vitamines, minéraux et oligo-éléments fonctionnent comme cofacteur/coenzyme de diverses systèmes enzymatiques, et sont donc impliqués dans tas de réactions métaboliques.
Le type de réaction biochimique catalysée par l'enzyme dépend du coenzyme (oxydation-réduction, hydrolyse...) : voir également "Les enzymes". En général à l'aide d'oligo-éléments (minéraux). En cas de carence en minéraux, l'organisme va puiser les minéraux manquants dans ses propres tissus (dents, os, cheveux). jusqu'à épuisement des stocks...
Certaines substances alimentaires telles que l'acide phytique (en particulier dans des céréales et des légumineuses) fixent des minéraux par chélation. Notre alimentation joue donc un grand rôle dans le bon déroulements de beaucoup de réactions enzymatiques... (p. ex. l'apparition de cheveux blancs et de vitiligo (blanchissement de la peau, une maladie auto-immune) suite à un défaut de catalase, causé par une déséquilibre minéral ![]() ).
).
Sommaire :
Des co-enzymes, exemples :
Lorsque le coenzyme est impliqué dans l'anabolisme de substances durant la biosynthèse, il possède un groupement phosphate supplémentaire sur le second carbone du ribose (NAD+ et NADPH).
Contenu :
 Le coenzyme A
Le coenzyme A
Le coenzyme A est formé à partir d'un groupement cystéaminique, d'un fragment d'acide pantothénique (vit B5) et de phosphate d'adénosine. L'acide pantothénique est la seule substance qui doit être apportée de l'extérieur, par l'alimentation/ des suppléments (d-calcium-pantothénate).
Sa partie réactive est la fonction thiol (-SH) : d'où son abréviation CoA-SH.
L'activité de l'acétylcoenzyme A est connue dans la biosynthèse d'acides gras. En effet, l'acétylCoA est un coenzyme-activateur de transfert de groupements acyle dans de très nombreuses voies du métabolisme cellulaire.
acétyl : - C = O
|
CH3
Le coenzyme A joue un rôle fondamental dans le métabolisme cellulaire des lipides, de certains protides et des glucides, métabolisés par intermédiaire de l'acétyl-CoA dans le cycle de l'acide citrique (Krebs, TCA : tricarboxylic acid cycle) en formant du CO2 et de l'énergie. Il est également impliqué dans la biosynthèse des acides gras et dans des réactions d'acétylation, telles que dans la formation de l'acétylcholine et du CoQ10/cholestérol, et dans la détoxication.
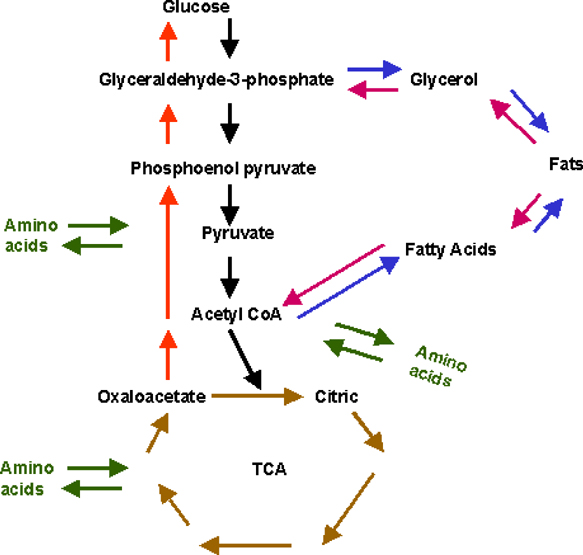
---> La disponibilité de l'acétyl-CoA (produit de la glycolyse anaérobie via le pyruvate ou à partir d'acides gras) est un facteur crucial dans le cycle de Krebs.
La coenzyme A est également indispensable dans d'autres processus biologiques tels que la synthèse hormonale. En cas de déficit en coenzyme A, l'organisme doit décider quel chemin métabolique à suivre : utiliser l'acide pantothénique disponible pour la synthèse hormonale ou pour la dégradation des lipides. Toutefois, étant donné que la synthèse d'hormones a toujours priorité (les organes de reproduction ne peuvent pas se développer sans), les lipides ne seront pas toutes dégradées. A la place d'être métabolisées et évacuées par la circulation sanguine, les lipides non métabolisées vont s'accumuler dans les glands et les pores et être éliminées sous forme de sébum, une forme liquide de lipides. En particulier les adolescents souffrent de l'acné : en effet, chez eux, la production hormonale est très prononcée.
 L'ATP (adénosine triphosphate)
L'ATP (adénosine triphosphate)
-
-
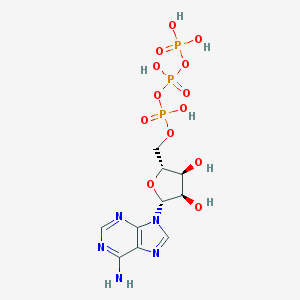
L'ATP (adénosine triphosphate, Adénine - Ribose~P~P~P) est un nucléotide, constitué d'une base azotée, associée à une molécule glucidique et à trois groupements phosphate énergétiques. C'est un coenzyme de transfert de groupements phosphate dans beaucoup de réactions enzymatiques.
-
- L'ATP peut être produit dans toutes les cellules végétales et animales, et est universellement disponible pour l'approvisionnement en énergie. L'ATP est donc une pièce maîtresse dans la gestion énergétique de l'organisme.
-
-
-
des réactions nécessitant de l'énergie (endergoniques) seront donc accompagnées d'une dégradation d'ATP en ADP, (cataboliques)
-
des réactions libérant de l'énergie (exergoniques) seront accompagnées d'une synthèse d'ATP à partir d'ADP ou d'AMP, fixant ainsi l'énergie libérée afin de l'utiliser ultérieurement dans des réactions anaboliques (anaboliques).
-
-
Ces deux types de réactions sont étroitement liés : quasi toute l'énergie obtenue par un type de réaction est utilisée par l'autre. Seule une petite partie est libérée sous forme de chaleur (---> important dans la gestion de la température corporelle).
-
-
L'ATP est également indispensable au déploiement spatial des protéines, p. ex. dans le cytoplasme cellulaire. Les protéines déployées offrent une structure à l'eau cellulaire. L'orientation spatiale détermine la charge électrique de la membrane extérieure de la cellule, qui garde une distance entre les cellules/empêche l'agglomération des cellules. La perte de structure de l'eau cytoplasmique est probablement co-responsable de la dysfonction mitochondriale ét de la formation d'une tumeur (agglomération de cellules).
-
-
-
A l'intérieur de la cellule, l'ATP fonctionne comme une batterie fournissant de l'énergie pour les processus biochimiques. Dans une cellule vivante, la production continuelle d'ATP est donc primordiale.
-
Réaction d'hydrolyse : libère de l'énergie.
Des enzymes catalyseurs d'une réaction endergonique génèrent l'énergie nécessaire en catalysant simultanément une réaction exergonique : libération de l'énergie par hydrolyse d'ATP (voir aussi : "Enzymes, vitesse de réaction").
-
-
-
une molécule d'ATP est considérée comme une combinaison "énergétique" : parce que l'hydrolyse du groupement triphosphate libère dans la cellule de l'énergie disponible pour d'autres réactions. Cette hydrolyse d'ATP est une réaction thermodynamique favorable . Elle a lieu dans la mitochondrie, un organite.
-
-
-
-
-
-
l'ATP est hydrolysé en ADP ou en AMP.
-
-
-
Synthèse
Les enzymes catalyseurs de réactions exergoniques peuvent utiliser l'énergie libérée pour reformer simultanément de l'ATP à partir de'ADP et de P (= réaction couplée)
-
-
-
avec passage d'ions (H+) : réaction catalysée par l'enzyme ATP-ase :
-
-
-
-
-
-
l'ATP est formé avec l'énergie dégagée par la respiration d'une molécule de glucose dans le cycle de l'acide citrique (dans les mitochondries). Les protons expulsés provoquent un gradient de pH, qui entraîne à son tour un flux d'ions.
-
-
-
-
-
-
-
-
on assiste ensuite à un transfert de protons sur leur transporteur, l'oxygène O2, pour former enfin du gaz carbonique, de l'eau et de l'énergie.
-
-
-
-
-
-
-
-
-
-
ce flux de protons (la chaîne de transport d'électrons) active également l'ATP synthase qui catalyse ensuite la phosphorylation de l'ADP + PI (un groupe phosphate minéral d'origine alimentaire H2PO4- ) ---> ATP (phosphorylation oxydative).
-
-
-
-
-
---> Cette énergie provient donc de l'oxydation des aliments ingérés (= énergie solaire).
-
-
-
sans passage d'H+ : catalyse multi-enzymatique :
-
-
-
-
-
-
l'ATP peut être également régénérée à l'aide de l'enzyme, la créatine-phosphokinase (CPK) à partir d'ADP + Pi ou,
-
-
-
-
-
-
-
-
par hydrolyse d'une combinaison à potentiel électrochimique élevé, couplée à la synthèse d'ATP à partir d'ADP et de PI (p. ex. la succinyl CoA synthase dans le cycle de l'acide citrique) ou,
-
-
-
-
-
-
-
-
-
-
par transfert d'un groupement phosphate riche en énergie vers l'ADP dans la réaction phosphotransférase (kinase) (p. ex. la pyruvatekinase) (phosphorylation du substrat).
-
-
-
-
-
Transport
-
-
-
Pour passer des mitochondries dans le milieu intracellulaire, l'ATP formée emprunte les services d'une enzyme ATPase et de Mg2+ dans un système de pompes (voir également : "Fonctionnement de la membrane cellulaire, systèmes de transport d'énergie").
-
-
En utilisant
-
-
-
-
l'antiport ADP3- (via le translocateur de l'adénine nucléotide)
-
-
-
--> l'ADP entre dans la mitochondrie
met Mg2+ ---> en échange avec l'ATP4- formé
--> l'ATP sort de la mitochondrie
-
-
-
-
l'antiport H2PO4- (via le translocateur du groupe phosphate)
-
-
-
--> le H2PO4- dans la mitochondrie
en échange avec l'OH- et l'ATP4- formé
--> l'ATP sort de la mitochondrie.
Voir aussi "Résumé des processus énergétiques".
-
-
A l'extérieur de la cellule, l'ATP joue un rôle dans la communication intercellulaire :
-
-
-
-
l'ATP, et un de ces produits de dégradation, l'adénosine (voir aussi : l'AMPc dans "Les fixations cellulaires sur récepteur"),
-
-
agissent ensemble dans le tronc cérébral, responsable de fonctions fondamentales telles que le rythme cardiaque, la respiration et la fonction gastro-intestinale (sécrétion des enzymes, contractions intestinales normales...), et également dans la contraction de la vessie, l'érection...
-
interviennent dans le sommeil, la mémoire, l'apprentissage et le mouvement.
-
-
au niveau du système nerveux, l'ATP agit avec d'autres neurotransmetteurs comme cotransmetteur de la noradrénaline ou de l'acétylcholine.
-
dans la communication entre les neurones du système nerveux périphérique, l'ATP régule, voire transmet, via des sous-types de récepteurs P2X et P2Y, des informations provenant des organes sensoriels : les yeux, les oreilles, le nez et la langue, vers le cerveau. Les nerfs sensitifs véhiculant la douleur l'utilisent aussi pour transmettre des signaux à la moelle épinière.
-
en outre, la communication intercellulaire utilisant l'ATP existe dans de nombreux types cellulaires, dont
-
-
le système cardiovasculaire : constriction, relaxation, prolifération cellulaire, coagulation sanguine...
-
le système immunitaire : inflammation, élimination des cellules infectées...
-
la peau : renouvellement normal des cellules cutanées, leur multiplication lors de la guérison, prolifération (psoriasis?)...
-
l'os : stimulation/inhibition des ostéoblastes/ostéoclastes (voir : "L'ostéoporose")
-
-
-
Pour être efficace, les nouveaux médicaments devront activer ou inhiber sélectivement des sous-types particuliers de récepteurs de l'ATP, empêcher ou augmenter la diffusion de ce médiateur, ou encore freiner sa dégradation après sa libération par les cellules. Un médicament déjà sur le marché, le clopidrogel (PLAVIX°) agit en bloquant le récepteur P2Y12 des plaquettes, empêchant la formation des caillots. D'autres médicaments pourraient bloquer les récepteurs de l'ATP au niveau de l'intestin inhibant ainsi des troubles d'inflammation intestinale tels que la maladie de Crohn ou combattre des douleurs neuropathiques ou les douleurs dues à l'inflammation.
 Le NAD+
Le NAD+
-
-
Forme oxydée : est donc un oxydant capable d'absorber des H+ et des électrons lors de sa réduction et agit comme un service de taxi qui transporte les électrons à travers vos cellules (Transpoteur d'électrons). Sans NAD+, vos cellules cellules ne peuvent pas convertir les aliments en énergie, réparer les dommages causés à l'ADN ou maintenir une bonne communication cellulaire. Les FAD (voir ci-dessous) et les NAD sont tous deux des transporteurs d'électrons, mais ils empruntent un chemin légèrement plus long, avec une efficacité différente. La dégradation des graisses produit plus des FAD, la dégradation des sucres plutôt des NAD+. Les NAD+ suivent une voie directe et entrent tout au début de la chaîne de transport d'électrons (Complexe I). Cela permet de produire plus d'ATP (parce que les électrons ont un temps de parcours plus long) tout en réduisant la production nocive de ROS.
-
-
-
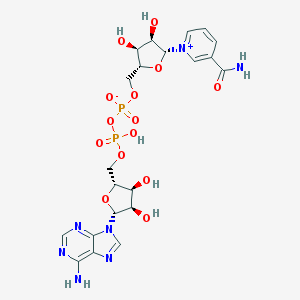
= Nicotinamide Adénine Dinucléotide : 2 x nucléotide (= base + sucre + groupement phosphate) :
-
Adénine - Ribose - P - O - P - Ribose - Nicotinamide
(Nicotinamide+Ribose = NDR : les suppléments de NDR peuvent stimuler la production de NAD+)
-
-
La Nicotinamide (niacine, vit B3) est formée à partir du tryptophane, un acide aminé essentiel, et fixée ensuite sur une molécule d'ADP (adénosine di-phosphate) :
-
Tryptophane ---> Acide nicotinique/Niacine/Niacinamide ---> NAD+
-
-
-
après réduction, le NAD est transformé, via la déshydrogénase, en NADH + H+, un transporteur d'électrons. Ce NADH (Nicotinamide Adénine Dinucléotide Hydrure) est dans la chaîne de transport d'électrons (chaîne respiratoire) réoxydé, réaction couplée avec la synthèse d'ATP riche en énergie (adénosine triphosphate) transformant l'O2 en H2O (métabolisme en aérobiose) :
-
-
NAD+ + 2e- + 2H+ ---> NADH (reduction)
NADH + H+ ---> NAD+ + 2e- + H+ (oxydation)
-
-
Le recyclage du NAD+ ---> (production d'énergie) ---> Nicotinamide (NAM) ---> via l'enzyme NAMPT (Nicotinamide-phosphobosyl-transférase) ---> NMN (Nicotinamide MonoNucléotide) ---> NAD+ (Salvage pathway : est la principale voie de synthèse intracellulaire du NAD+). Le NAD+ peut être également recyclé par intermédiaire du shuttle (navette) Glycérol-3P/DHAP en présence de la CoQ10 (voir aussi : "Avantages de la glycolyse anaérobie").
-
Le NAD+ est le capteur d'électrons le plus important lors de l'oxydation de molécules de combustion.
- Le NAD+ est aussi appelé 'la molécule de la jeunesse' est essentiel pour diriger l'activité des sirtuines (SIRT1 et SIRT3). Ces protéines ont besoin de NAD+ pour leur fonctionnement (stimuler la fonction et la formation de nouvelles mitochondries). Les sirtuines (SIRT1 et SIRT3) et le NAD+ forment une sorte de paire de rêve dans la régulation du métabolisme énergétique. Pour les sirtuines, la NAD+ est indispensable pour être activées et protéger les cellules. Toutefois, avec l'âge, le niveau de la NAD+ diminue... Mais une baisse de ce taux est également associée à des troubles métaboliques, à la sarcopénie, à l'Alzheimer et au Diabète.
---> Un complément alimentaire à base de NAD ne permet pas d'acheminer cette substance au bon endroit dans la cellule. La vitamine B3 est un précurseur du NAD+ via le NMN (NicotinamideMonoNucléotide).
La diminution du rapport NAD+/NADH est associée au vieillissement et à une production accrue de ROS. Le NADH est le donneur d'électrons pour la chaîne de transport d'électrons. Plus de NADH ---> plus de transport d'électrons ---> plus de ROS comme sous-produit de la phosphorylation oxydative ---> plus de stress oxydant.
Une diminution du NAD+ a un effet négatif sur la capacité des mitochondries à produire de l'ATP. Le métabolisme se déplace vers la glycolyse (effet de Warburg). En cas de pénurie d'ATP, la production de NAD+ s'arrête. Cela illustre la dépendance mutuelle du NAD+ et de l'ATP, les deux molécules étant essentielles à la production et au fonctionnement de l'une et de l'autre.
-
-
Dans la biosynthèse d'acides gras, 2 molécules du NADH vont livrer les 4 électrons nécessaires à la réduction du groupement carbonyle en groupement méthylène.
-
---> de cette façon, le NADH joue le rôle de cofacteur de plus de 1000 enzymes.
-
-
Les NADH sont des antioxydants à action indirecte : c.à.d. ils ne présentent aucune interaction avec des radicaux libres agressifs. Cependant, ils contribuent au potentiel antioxydant de la cellule en régénérant des antioxydants oxydés. Le NADH réduit ainsi le glutathion oxydé (GSSH), en formant l'antioxydant intracellulaire le plus important: le glutathion réduit (GSH).
-
-
-
Sites d'action : le NAD+ est une molécule présente dans chaque cellule du corps qui contribue au transfert de l'énergie entre les molécules. Dans les cellules saines, il existe un équilibre entre le NAD+ et le NADH qui est essentiel pour la production d'énergie. Des troubles tels que le cancer ou le diabète perturbent cet équilibre, entraînant un excès de lactate et une réduction de NAD+. Le dioxyde de carbone est essentiel car il empêche la production excessive de lactate et maintient le rapport entre NAD+ et NADH.
-
-
-
-
Le NADH est le porteur d'électrons le plus dominant dans le métabolisme d'énergie et dans le catabolisme :
-
-
NAD+ + 2e- + H+ <---> NADH
-
-
-
Le NADPH est le porteur d'électrons le plus dominant dans l'anabolisme : le NADP+ est réduit par la voie oxydative de la voie des pentoses phosphates (cycle PPP) ; le NADPH représente donc la source la plus importante d'électrons anaboliques :
-
-
NADP+ + 2e- + H+ <---> NADPH
Le NADPH est aussi important que l'ATP, parce que le NADPH forme la source primaire d'électrons pour recharger des antioxydants tels que glutathion, vit C et vit E.
Le facteur déterminant pour la plupart des ROS créés est le rapport NADH / NAD+. Le NADH est la forme réduite et le NAD+ la forme oxydée. Ce rapport régule également la vitesse du métabolisme des glucides, car l'étape limitant la vitesse est la pyruvate déshydrogénase.
À l'état oxydé, c'est-à-dire lorsque le NAD+ prédomine, la pyruvate déshydrogénase fonctionne bien et les électrons circulent dans le cycle de Krebs et la chaîne de transport d'électrons.
Lorsque le NADH prédomine, il y a trop d'électrons ... qui n'obtiennent pas l'oxygène correctement. Il faut alors faire quelque chose de ces électrons. Deux possibilités : augmentation de la synthèse des ROS ou consommation de ces électrons supplémentaires pour synthétiser des graisses.
L'obésité, ou du moins l'obésité extrême, peut donc être considérée comme un mécanisme désespéré visant à se débarrasser des électrons provenant des aliments, mais qui ne sont pas traités correctement. En d'autres termes, la nourriture n'est pas brûlée correctement. Qu'en advient-il alors ? Il est stocké ! C'est la seule chose que le corps puisse faire.
D'ailleurs, si vous êtes obèse ou en surpoids important, vous avez toujours de grandes quantités de ROS, car ce sont les deux seules choses que le corps peut faire avec les électrons supplémentaires. Il ne peut pas simplement les vaporiser, bien que certaines recherches sur la mise à la terre montrent qu'il est possible de se débarrasser des électrons excédentaires de cette manière.
-
-
-
Via la transhydrogénase, le NADPH peut également être formé à partir du NADH :
-
-
NADH + NADP+ <---> NADPH + NAD+
Voir aussi : "Mécanismes d'oxydoréduction".
- Ensuite, le NADH contribue à :
- la stimulation du système immunitaire par stimulation de la synthèse d'IL-6 : lorsque les taux d’IL-6 sont trop bas, cela peut être le signe d’une défense immunitaire affaiblie face à divers agents pathogènes. C’est justement ce que l’on constate au cours de l’apparition de maladies dégénératives comme Alzheimer, Parkinson ou la sclérose en plaques (SEP). L’IL-6 est également capable de contrôler la puissance de la réponse inflammatoire aiguë, et possède donc une action anti-inflammatoire
- la production de van dopamine et de sérotonine : la baisse de la dopamine est impliquée aussi bien dans la dépression que dans la maladie de Parkinson. D’autre part, la dopamine abaisse la sécrétion de prolactine et diminue l’appétit. Le NADH pourrait donc être conseillé aux personnes obèses pour les aider à diminuer leur appétit. Cela pourrait, en partie, expliquer certaines pertes de poids observées en cas de supplémentation prolongée
- la production van NO (monoxyde d'azote) : améliore ainsi la circulation du sang vers des organes essentiels comme le cœur et le cerveau. Cette action spécifique pourrait également améliorer les capacités érectiles chez l’homme.
- la réparation de l'ADN
- la normalisation du bilan lipidique et à abaisser la tension artérielle
- ...
- Indications : SFC (Syndrome de la Fatigue Chronique), dépression, diabète de type 2, obésité, dysfonction érectile...
 La FAD+
La FAD+
-
-
Forme oxydée : est donc un oxydant capable d'absorber des H+ et des électrons lors de sa réduction (Transpoteur d'électrons). Le FAD et le NAD sont tous deux des transporteurs d'électrons, mais ils empruntent un chemin légèrement plus long, avec une efficacité différente. La dégradation des graisses produit plus des FAD, la dégradation des sucres plutôt des NAD. Les FAD ne peuvent fournir des électrons que plus tard dans le processus de production d'énergie (complexe II de la chaîne de transport d'électrons) en raison d'un chemin plus long et moins efficace, ce qui se traduit par une production plus faible d'ATP.
-
-
-
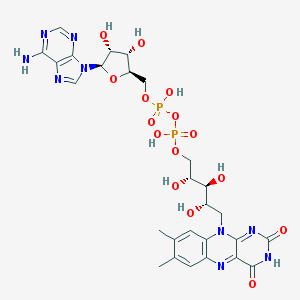
Flavine Adénine Dinucléotide : 2 x nucléotide (= base + sucre + phosphate) :
-
Adénine - Ribose - P - O - P - ribityl - Flavine
-
-
La partie ribityl-flavine est formée lors d'une scission enzymatique de la vit B2, Riboflavine.
-
-
-
Après réduction, la FAD est transformée en FADH2 , un transporteur d'électrons :
-
FAD+ ---> réduction + 2H+, + 2e- ---> FADH2
-
-
La FAD+ agit e.a. comme capteur d'électrons dans l'oxydation des alkanes en alkènes et elle est simultanément réduite en FADH2 dans le couple rédox suivant :
-
FADH2 ---> oxydation -2H+, -2e- ---> FAD+ ---> réduction + 2H+, + 2e- ---> FADH2
-
-
Associée à la FMN, la FAD est un coenzyme d'oxydoréduction important dans les réactions enzymatiques.
-
-
-
Le cycle catalytique de la flavine mono-oxygénase (FMO) peut entrer en compétition avec le cycle SAM (voir également "Homocystéine") en cas de surcharge en xénobiotiques (X) soufrés :
-
-
-
-
FMO-FAD ---> + NADPH + H+ ---> FMO-FADH2 (NADP+) ---> + O2 ---> FMO-FADHOOH (NADP+)
-
-
-
-
-
-
FMO-FADHOOH (NADP+) + X ---> FMO-FADHOH (NADP+) + XO
-
-
-
(complexe enzymatique de vit B9, B2, B3 comme cofacteurs)
-
-
-
-
-
FMO-FADHOH (NADP+) ---> NADP+ + H20 + FMO-FAD
-
-
-
-
(Xénobiotiques : en particulier les xénobiotiques soufrés (S) tels que : thiols, thio-amides, mercapto-imidazole, thiocarbamate, carbamides présents dans le plastic, le caoutchouc..., dans les herbicides, les fongicides...).
Ce cycle de flavine ne fonctionne pas si les taux d'homocystéine sont trop élevés, puisque le recyclage de l'homocystéine nécessite trop d'acide folique.
 Le GSSH
Le GSSH
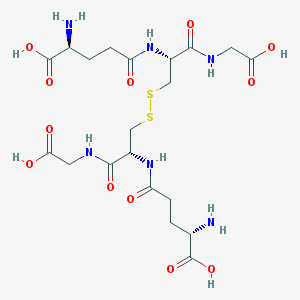
Glutathion (GSH, GSSH) :
-
-
Forme oxydée : est donc capable d'absorber des H+ et des électrons lors de sa réduction.
-
-
-
Le glutathion oxydé GSSH, un disulfide, est réduit en GSH via la GSH réductase et à l'aide du complexe TPP (thiamine pyrophosphate (à base de vit B1).
-
-
-
Inversement, le GSH peut être oxydé en GSSH via la GSH peroxydase, en présence de Se (sélénium) comme cofacteur :
-
GSSH ---> GSH réductase/TPP/NADPH (voir shunt PPP) ---> GSH + NADP+ ---> GSH peroxydase + Se ---> GSSH
-
-
Le GSH possède une forte capacité d'induction, pouvant répondre à la demande accrue des acides gras essentiels et du sélénium :
-
-
-
-
le rapport GSH/GSSH reflète le degré d'oxydation des processus biologiques,
-
dans la plupart des tissus, le rapport GSH/GSSH est quasi égal à 10 ; un résultat inférieur à 10 démontre un degré d'oxydation plus élevé que la normale.
-
-
Le GSSH n'est donc pas un antioxydant; il le devient seulement lorsque il a été réduit en GSH. Le NADH joue ici un rôle essentiel comme coenzyme.
-
-
Le GSH peut, dans l'organisme, régénérer la vit C oxydée en vitamine C active, laquelle peut à son tour régénérer la vitamine E oxydée en vitamine E active.
-
-
-
Le GSH intervient dans la phase 1 de la détoxication hépatique (MFO) par liaison avec des toxines (métaux lourds, solvants, pesticides...).
-
-
-
Le GSH joue également un rôle important dans la réponse immunitaire en régulant la différenciation des lymphocytes B et T. Le GSH agit comme régulateur de l'écosystème PG-TX-LT (voir : "Le profil PG-TX-LT"). Une carence en GSH empêche la multiplication des lymphocytes.
-
-
le GSH améliore la fonction des cellules T auxiliaires et
-
-
arrête des réactions inflammatoires
-
adoucit des réactions allergiques
-
stimule le système immunitaire
-
protège l'organisme contre le cancer
-
-
-
-
-
-
une augmentation des valeurs sanguines de glutathion par la NAC (N-acétyl-cystéine) diminue les taux sanguins d'interleukine-10 (IL-10), IL-6, TNF-alfa et IL-1 (voir : "Cytokines").
-
la glutamine (un composant du glutathion) régule le système immunitaire :
-
-
les lymphocytes et les macrophages nécessitent beaucoup de glutamine,
-
la glutamine stimule la production des lymphocytes et l'activité des cellules NK (Natural Killer).
-
-
-
-
-
Sites d'action/avantages du GSH :
-
-
-
-
l'antioxydant mitochondrial le plus puissant
-
protège le cholestérol contre l'oxydation
-
élimine des substances carcinogènes
-
contribue à la détoxication d'alcool
-
module l'insuline
-
protège notre capital génétique en préservant la taille des télomères
 .
. -
...
-
-
-
-
Avec l'âge (à partir de 35 - 40 ans), la production endogène du glutathion diminue : les toxines non éliminées s'accumulent, perturbent l'activité hormonale, induisant à terme le développement de maladies telles que : obésité, diabète, maladies cardiovasculaires...
-
Reduisent également les niveaux du glutathion :
-
le tabac, l'alcool, certains médicaments (e.a. le paracétamol), le diabète, certaines maladies neurodégénératives, le sport trop intensif...
-
-
Le métabolisme humain oxyde le paracétamol en une iminoquinone, laquelle réagit par la suite avec le soufre du glutathion pouvant donner une liaison stable soufre carbone qui enlève toute propriété antioxydante au glutathion. On retrouve le fait que la maladie est d’autant plus dangereuse que le taux de glutathion est faible, tendance que l’on retrouve bien entendu d’abord chez les personnes âgées, mais aussi sans doute chez celles ayant abusé de paracétamol.
Les personnes décédées de la covid n’auraient-elles pas présenté un important déficit en glutathion ? La prise de paracétamol, n'est-elle pas contre-indiquée?
Consommez des aliments riches en soufre tels que l'ail, les oignons et le brocoli, qui aident votre corps à produire davantage de cet antioxydant essentiel. Le NAC est l'antidote d'urgence utilisé dans les hôpitaux en cas de surdosage de paracétamol, car il reconstitue très rapidement le glutathion. En stimulant le glutathion, le NAC aide à neutraliser les sous-produits toxiques du paracétamol et prévient une insuffisance hépatique catastrophique.
-
-
Sources :
-
-
des aliments riches en glutathion : asperges, ail, melon, avocats... mais le glutathion administré par voie orale sera détruit dans l'estomac avant d'arriver dans la circulation sanguine
-
des aliments riches en précurseurs du glutathion (cystéine, glycine, glutamate) : petit-lait (voir: "Lait et produits laitiers"), germes de blé, flocons d'avoine, noix, graines, oignons, légumineuses...
-
la NAC (N-acétylcystéine comme source de cystéine), avec la vit D, la vit E, la vit C, l'acide alfa lipoïque et la silymarine augmentent la production endogène du glutathion dans l'organisme.
-
bouger augmente également la production endogène du GSH, parc que bouger augmente les concentrations d'ATP. Et l'ATP (via le shunt PPP) est indispensable dans la production du GSH.... Et des niveaux élevés de glutathion stimulent le système immunitaire... (voir plus haut).
-
Déficiences : l'importance de la glutathion dans la production énergétique, la détoxication et la prévention de maladies liées à l'âge, est principalement déterminée par son impact sur la fonction des mitochondries. Des déficiences sont donc mises en rapport avec le développement de :
-
maladies liées à l'âge telles que Alzheimer et Parkinson...
-
maladies auto-immunes
-
l'arthrite, l'asthme et des affections inflammatoires
-
cancer
-
faiblesse musculaire et fatigue
-
...
-
-
Glutathion peroxydase (GPX) :
-
-
-
élément clé dans le système de défense antioxydant avec l'aide du glutathion (GSH) (voir plus loin) et du sélénium (c'est la raison pour laquelle le sélénium possède des propriétés antioxydantes
-
continue le travail amorcé par la SOD dans le cytosol, le plasma et les membranes cellulaires
-
impliquée dans l'élimination les produits toxiques issus de l'oxydation des acides gras à longue chaîne ou du cholestérol (l'hydroperoxyde R-OOH en alcool R-OH)
-
transforme le peroxyde d'hydrogène en donnant un électron
-
prévient la formation du radical hydroxyle
-
-
coenzymes : Se et vitamine B2
-
synergie : avec la vitamine E
-
-
le niveau des GPX est influencé par l'intensité du stress oxydant subi par l'organisme. Toutefois, un taux élevé ne reflète pas forcément un bon apport en sélénium. Dans la DMLA, une maladie oxydative de la rétine, on observe des taux élevés de GPX.
-
-
Glutathion s-tranférase (GST) :
-
-
-
agit au niveau du foie
-
neutralise les toxines métaboliques
-
-
Glutathion réductase (GRD) :
-
-
-
reconstitue la glutathion réduit à partir du glutathion oxydé (GSSH)
-
-
 La CoQ10
La CoQ10
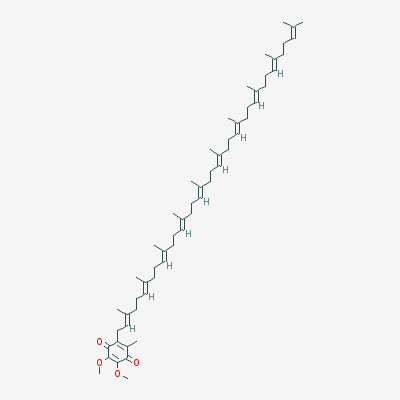
La coenzyme Q10, ou l'ubiquinone, parce que ces substances existent chez tous les êtres vivants, dans chaque cellule d'animaux, de végétaux ou micro-organismes (ubiquité).
Valeurs normales plasmatiques de référence (CHU de Liège) pour l'ubiquinone (CoQ10) : 0.3 à 1.39 mcg/ml (bien que d'autres études rapportent des taux allant jusqu'à 3.84 mcg/ml). Ces valeurs diminuent avec l'âge (30% à 40 ans, 57% à 80 ans) et baissent davantage si vous prenez des statines.
La coenzyme Q10 est indispensable à la santé cardiovasculaire, comme carburant pour les cellules cardiaques très riches en mitochondries, et comme antioxydant permettant de diminuer le cholestérol oxydé, cause de l'obstruction des artères coronaires.
La coenzyme Q10 existe sous deux formes redox : l'ubiquinone (forme oxydée) et l'ubiquinol (forme réduite). Ces deux formes sont fonctionnellement liées : l'organisme les transforme en permanence en fonction des besoins cellulaires (chaîne respiratoire mitochondriale, équilibre redox, conditions physiologiques). L'ubiquinol est plus instable et s'oxyde plus facilement, tandis que l'ubiquinone est généralement plus stable et souvent plus facile à formuler.
-
-
est un oxydant capable d'absorber des H+ et des électrons lors de sa réduction : l'ubiquinone ou la Coenzyme Q10 dans l'alimentation ou dans les suppléments alimentaires n'est donc pas encore un antioxydant; il le devient après avoir été réduit en QH2 (CoQ10H2, Ubiquinol ou Hydroquinone) dans l'organisme. La CoQ10H2 est donc la seule dotée de propriétés antioxydantes.
-
---> le NADH joue ici un rôle essentiel comme coenzyme.
-
-
-
cette réduction se déroule uniquement dans la cellule via le NADH. Ce qui veut dire que l'administration de CoQ10 seul n'est pas très utile, sauf si la quantité de NADH disponible dans la cellule est suffisante pour la réduction de la CoQ10 ;
-
-
-
-
-
en cas de déficit intracellulaire de NADH, l'administration de suppléments de CoQ10 peut épuiser la réserve du NADH, entraînant des conséquences inévitables pour la propre production d'énergie intracellulaire (dégénération?) ;
-
-
-
-
-
en cas de stress intense et chronique (donc aussi en cas d'efforts sportifs intenses...), la capacité de réduire l'ubiquinone en ubiquinol est altérée : la comparaison des taux plasmatiques d'ubiquinol avec ceux d'ubiquinone (rapport ubiquinol/ubiquinone) est un indicateur du niveau de stress oxydant de l'organisme.
-
-
---> ce rapport ainsi que la coQ10 total sont plus faibles en cas de maladies cardiovasculaires, de diabète, de migraine et de maladie de Parkinson.
Note : L'ubiquinol, la forme réduite (donc la forme directement utilisable (oxydable) dans l'organisme), est maintenant également disponible sous forme de supplément alimentaire, assurant une forte réaction de défense contre les espèces oxygénées activées (EOA) ou radicaux libres. En outre, cette forme réduite permet d'offrir des bénéfices du traitement aux patients dont les systèmes enzymatiques sont altérés, ce qui est précisément le cas chez les patients atteints d'insuffisance cardiaque, traités par statines, âgés...
-
-
La Ubiquinol CoQ10H2 est liposoluble et LE transporteur d'électrons lipophile dans des environnements riches en graisses (tels que la membrane cellulaire), et fonctionne comme coenzyme avec l'acide alpha-lipoïque et l'acétyl-L-carnitine dans le processus complexe de la génération cellulaire d'énergie (mitochondries): il est responsable pour 95% de la production énergétique totale. La CoQ10 est le chaînon, le "carrier" entre les complexes enzymatiques de la chaîne respiratoire mitochondriale (synthèse mitochondriale d'ADP ---> ATP). Chez l'homme, le Q10 est donc présent en particulier dans les cellules à combustion énergétique élevée telles que les cellules musculaires, cardiaques, rénales et hépatiques. La CoQ10 booste notre niveau d'énergie. Dans notre corps, la conversion de CoQ10 vers l'ubiquinol (réduction) a lieu des milliers de fois par seconde dans un processus qui transforme les aliments en énergie...
-
-
-
Le Q10 est formé lors de la synthèse du cholestérol : son apport alimentaire trop important freinera la synthèse de CoQ10. L'administration d'hypolipidémiants (statines) aussi.
-
Alimentation ---> hydrates de carbone/lipides
---> AcétylCoA ---> Mévalonate ---> Farnesyl-pyrophosphate ---> Squalène ---> Cholestérol
et ensuite :
-
-
-
à partir de farnesyl-PP ---> Q10 trans, Dolichol (transporteur d'acides aminés), isopentanyladénine (tRNA), Hème A (dans la cytochrome oxydase)...;
-
à partir de cholestérol ---> hormones stéroïdes, cortisol, DHEA, vit D, incorporation dans la structure membranaire...
-
-
-
-
Sources naturelles : huile de soya, huile de rave...; viande de boeuf, abats...; maquereau, sardines...; arachides (grillées), semence de sésame (grillée)...
-
-
-
Le Q10 peut
-
-
-
-
capter indirectement des radicaux libres, et limiter la détérioration oxydative des membranes mitochondriales
-
améliorer la respiration cellulaire et favoriser la consommation calorique
-
augmenter la résistance (immunomodulateur)
-
augmenter les capacités aérobies, ainsi que les prestations musculaires (affections musculaires (fibromyalgie...), Parkinson...)
-
diminuer la fatigue accompagnant des maladies telles que sclérose en plaque
 , fibromyalgie...
, fibromyalgie... -
protéger le LDL endogène contre l'oxydation (antioxydant endogène au niveau cardiovasculaire)
-
recycler la vitamine E par régénération de la vitamine E oxydée (peroxydation lipidique) : la coQ10 et la vitamine E sont donc toutes deux des antioxydants puissants, la vitamine E n'a toutefois aucune action au niveau du transport des électrons dans la chaîne respiratoire (mitochondries), à l'inverse de l'ubiquinone
-
diminuer la concentration des corps cétoniques chez le patient diabétique : l'oxydation des substances alimentaires (lipides, hydrates de carbone, protéines) produit de l'énergie (ATP) dans la chaîne respiratoire (transfert d'électrons) mitochondriale. Cette chaîne respiratoire est constitué de différents systèmes de transport pour protéines rédox telles que la coenzyme Q10 (CoQ10).
-
assure une action antioxydante dans les mitochondries et les membranes lipidiques, et peut jouer un rôle dans la prévention de pathologies neurodégénératives telles que l'Alzheimer
 .
. -
développer un effet hypotensif en protégeant le NO, molécule vasodilatatrice libérée par la paroi des vaisseaux (niveau cardiovasculaire) : utile dans le contrôle de l'hypertension artérielle
-
protéger en cas d'états ischémiques (propriété de "life extension")
-
compenser certaines déficiences causées par différents médicaments (inhibiteurs de la synthèse du cholestérol tels que les statines...)
-
améliorer en cas d'insuffisance cardiaque la fonction de pompe et le volume cardiaque (décompensation cardiaque)
-
constituer un élément important dans le contrôle de l'obésité et du syndrome métabolique : des données récentes chez l'animal montrent que le Q10 est capable de contrecarrer le stress métabolique, oxydatif et inflammatoire qui est observé en cas de syndrome métabolique et d'obésité (l'inflammation fait partie intégrale de l'altération métabolique liée à l'obésité : elle provoque un stress cellulaire, altère le métabolisme de plusieurs organes (p. ex. la cavité buccale entraînant des gingivites) et favorise l'apparition d'un diabète de type 2)
-
améliorer la qualité des spermatozoïdes chez des hommes souffrant de troubles idéopathiques de fertilité ; le Q10 aide à répondre aux besoins élevés en ATP pour la motilité des spermatozoïdes
-
troubles de fertilité chez la femme : la fertilité est essentiellement un défi énergétique et oxydant; le Q10 aide à répondre aux besoins élevés en ATP pour la maturation des ovocytes et le développement précoce des embryons
-
...
-
-
-
-
Le pool CoQ10 :
-
est constitué à partir de
-
-
-
un apport alimentaire de Q10 trans naturel (sardines, maquereau, porc, épinards...). Son absorption est améliorée par la présence de vitamines du groupe B et de fer. En général, l'apport par l'alimentation n'est pas indispensable, étant donné que l'organisme, en temps normal, est capable de synthétiser suffisamment de Q10.
-
-
-
-
-
la formation endogène du Q10 trans à partir de l'acétylCoA via le mévalonate dans le foie à l'aide de la HMG CoA réductase. L'ubiquinol endogène diminue avec l'âge.
-
-
---> L'acide mévalonique est aussi bien le substrat pour la synthèse du cholestérol que pour celle du coenzyme Q10.
-
-
-
des suppléments alimentaires : le Q10 d'origine synthétique est un mélange de Q10 trans et cis. Toutefois, la forme cis n'est pas reconnue par l'organisme. La CoQ10 obtenue par fermentation par contre offre également la forme trans active, présentant une bonne biodisponibilité.
-
-
![]() En bloquant la synthèse du cholestérol, les statines provoquent indirectement une diminution des taux du coenzyme Q10 dans l'organisme. En cas de taux trop faibles de Q10, la production d'ATP risque d'être inhibée. En particulier, les cellules les plus actives, telles que les cellules cardiaques, les globules blancs, les cellules des muscles du squelette subissent fortement ce déficit. Pour cette raison, les patients traités par statines souffrent de douleurs musculaires.
En bloquant la synthèse du cholestérol, les statines provoquent indirectement une diminution des taux du coenzyme Q10 dans l'organisme. En cas de taux trop faibles de Q10, la production d'ATP risque d'être inhibée. En particulier, les cellules les plus actives, telles que les cellules cardiaques, les globules blancs, les cellules des muscles du squelette subissent fortement ce déficit. Pour cette raison, les patients traités par statines souffrent de douleurs musculaires.
est utilisé dans
-
-
-
comme transporteur d'électrons lipophile
-
-
dans la chaîne respiratoire mitochondriale (--> énergie!),
-
dans la membrane plasmatique
-
dans les lysosomes
-
-
les processus de détoxication : utilisé au niveau hépatique dans la phosphorylation oxydative mitochondriale
-
la pathologie des radicaux libres : antioxydant des peroxydes
-
-
---> Le Q10 est donc particulièrement présent dans les tissus cardiaques, le foie et le système immunitaire.
-
-
Inhibiteurs du Q10 :
-
-
-
-
inhibiteurs de la synthèse du cholestérol (statines) : ils partagent le même processus biochimique; les statines diminuent ainsi les taux cellulaires et mitochondriaux de CoQ10, indispensable à la respiration cellulaire
-
cholestérol diététique : freine la HMG CoA reductase
-
glucocorticoïdes (cortisol)
-
excès de glucagon (réaction sur l'hypoglycémie, telle que lors d'une hyperinsulinémie)
-
stress, AMPc ...
-
en cas de surcharge (pollution, chirurgie, efforts sportifs intenses...)
-
bétabloquants : inhibent les enzymes dépendants du Q10
-
diminution des taux de LDL sérique : le LDL est le transporteur de béta-carotène et de Q10...
-
jeûne, régimes d'exclusion...
-
....
-
-
-
-
Déficit en Q10 en cas de :
-
-
-
-
personnes âgées : diminution de la synthèse endogène
-
pathologie cardiovasculaire : le Q10 a été utilisé avec succès dans l'insuffisance cardiaque


-
migraine : avec 150 mg par jour de CoQ10, on a observé, chez 61% des patients, une diminution de 51% de jours avec migraine


-
traitement anticholestérol par des statines p. ex. : des suppléments de Q10 peuvent aider dans la prévention de douleurs musculaires
-
régimes pauvres en cholestérol et en graisses, végétariens sous régime pauvre en graisses
-
une ThérapieHormonale de Substitution (THS) durant la ménopause

-
maladie de Crohn, et d'autres maladies de malabsorption
-
habitudes alimentaires pauvres en fruits, légumes et céréales
-
états alimentaires marginaux : déficiences en vit B6, vit E et en Se, indispensables pour la synthèse du Q10
-
sportifs, étudiants, managers, avec des besoins énergétiques élevés : consomment en moyenne plus d'ATP ; pour régénérer l'ADP en ATP, le transporteur d'électrons Q10 est crucial
-
...
-
-
-
-
Prudence :
-
Taux sériques normaux estimés de la CoQ10 : 0.30 à 3.84 mcg/ml. Cependant, son contenu dans les tissus diminue avec l'âge.
Un apport journalier de 15 à 30 mg CoQ10 permettrait de couvrir les besoins. Le contenu de l'alimentation en coenzyme Q10 est relativement faible. Il est donc quasi impossible d'augmenter cet apport de manière significative en modifiant le régime. En cas de déficit, le recours aux suppléments est à envisager.
Attention, le Q10 d'origine synthétique est un mélange de Q10 trans et cis. Toutefois, la forme cis n'est pas reconnue par l'organisme. La CoQ10 obtenue par fermentation offre également la forme trans active présentant une bonne biodisponibilité.
Les seules données existantes indiquent qu'il faut un apport journalier de minimum de 30 à 100 mg de CoQ10 sous forme d'ubiquinone ou de 30 à 300 mg sous forme de ubiquinol, comme complément pour faire augmenter de façon significative le taux plasmatique de 0.55 mg/l et 1.36 mg/l. En cas de pathologie, on a pu aller jusqu'à 3 g et plus, sans altérer la production endogène et sans effets secondaires.
-
-
-
l'administration de Q10 peut au début du traitement entraîner des effets temporaires de fatigue (phase de transition)
-
les formulations contenant la CoQ10 dispersée dans de l'huile (gélules molles) apportent les meilleurs résultats au niveau de la biodisponibilité (puisque la CoQ10 est lipophile)
-
l'action des bêtabloquants (antihypertenseurs) peut être renforcée par le Q10
-
l'action de warfarine (anticoagulants) peut être réduite par le Q10
-
l'action des médicaments contre le diabètes peut être renforcée par le Q10
-
le Q10 peut entraîner des troubles gastriques
-
toutefois, ne pas administrer des suppléments de Q10 durant la grossesse et l'allaitement et en cas d'hypersensibilité
-
administration durant un traitement anticancéreux : Fondation contre le cancer
-
on obtient des taux sériques de CoQ10 équivalents grâce à un apport journalier de 150mg d'ubiquinol ou de 1200mg d'ubiquinone, et 300mg d'ubiquinol (100mg, 3x par jour) correspond à 2400-3000mg d'ubiquinone

 .
.
-
-
 Autres :
Autres :
Biotine (vit B2), Tétrahydrofolate (>B9), Coenzyme B12, Pyridoxal phosphate (> B6), Thiamine pyrophosphate (> B1)...
